依靠II期单臂试验IIT数据,第一三共申请溶瘤病毒药物在日上市|第一现场

1月6日,一种溶瘤病毒药物Teserpaturev(G47∆,DS-1647)用于治疗恶性、复发性神经胶质母细胞瘤患者的II期单臂临床试验结果达到了1年生存率为为92.3%的主要终点指标。该药物的共同开发者第一三共制药向日本厚生劳动省(MHLW)递交了上市申请。G47∆由东京大学医科学研究所附属医院脑肿瘤外科医生藤堂具纪教授发现,并主导发起了临床研究。G47∆是第三代溶瘤单纯疱疹病毒1型(HSV-1)。
据日本业内人士透露,该研究从临床前到实施,完全由藤堂具纪教授团队主导(即研究者发起的临床研究IIT,日语称“医师主导的治验”),这是日本药品开发史上由学术界发起的创新药开发的成功案例,并首次在日本确认了HSV-1对恶性脑肿瘤显示治疗效果。这项研究结果之所以引起国内关注,深圳亦诺微医药公司联合创始人、首席研发官临床运营总监倪东耀博士认为,该产品与Duke大学研发的溶瘤病毒PVSRIPO和Dnatrix诸多不一样,如另外两个病毒都只是单次给药,而G47∆的给药次数较多、患者使用后一年生存率明显高于另外两个产品;但长期生存率还有待观察。
“特别是该项临床研究完全由研究者主导,仅用一个II期单臂试验就向日本药品监管机构提出申请,希望中国在支持新药审评上能与国际更加接轨。“倪东曜说。
G47Δ的临床试验设计方案
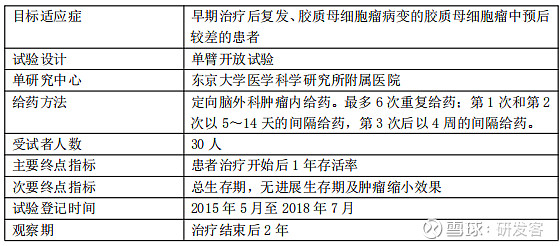
来源|国立大学法人东京大学官网
中间分析结果
据藤堂具纪教授介绍,他和研究团队是在患者手术后进行放疗和化疗(替莫唑胺)的标准治疗基础上,追加使用人工改变三重变异3个HSV-1的G47Δ。研究结果显示,主要终点指标1年的生存率为92.3%(13例中有12例在治疗后生存长达1年以上),与标准治疗1年生存期15%相比明显提高;16名受试者中,发生的主要不良反应为发热15名(93.8%)、呕吐及淋巴细胞数减少各8名(50.0%)、恶心7名(43.8%),需要延长住院时间的只有发热2名(均为轻度)(12.5%),“这表明,这是安全性较高的疗法。”相关研究者说,G47Δ的有效性已确定。经独立数据监测委员会的建议,结束了受试者的登记。
G47Δ的有效性得到确认后,第一三共制药立即递交了G47Δ的上市申请。前几年,第一三共就参与合作。2016年2月,该药由第一三共申请,获得了MHLW 下属的PMDA(独立行政法人医药品医疗器械综合机构)的先驱审查指定资格(Sakigake),相当于突破疗法。G47∆还在2017年获得孤儿药资格。预计PMDA此次将以企业申请后6个月作为批准目标的审查期。如果获批,该药将成为日本首个溶瘤病毒药物。
什么是溶瘤病毒疗法
从2009年开始,东京大学的研究人员就开展了G47Δ的首次人体试验。藤堂教授团队不仅用自行培养的细胞和动物开展临床前研究,试验样品也由研究小组在东京大学医科学研究所内的设施制造,属于彻头彻尾的IIT转化研究。
东京大学医学科学研究所附属医院脑肿瘤外科教授东藤友纪介绍了溶瘤病毒疗法。溶瘤病毒疗法是通过对致病力较弱的病毒进行基因改造制成特殊的溶瘤病毒,利用靶细胞中抑癌基因的失活或缺陷从而选择性地感染肿瘤细胞,在其内大量复制并最终摧毁肿瘤细胞。同时它还能激发免疫反应,吸引更多免疫细胞来继续杀死残余癌细胞。另一方面,感染正常细胞的基因重组病毒具有不能增殖的结构,因此正常组织不会受损(图1)。
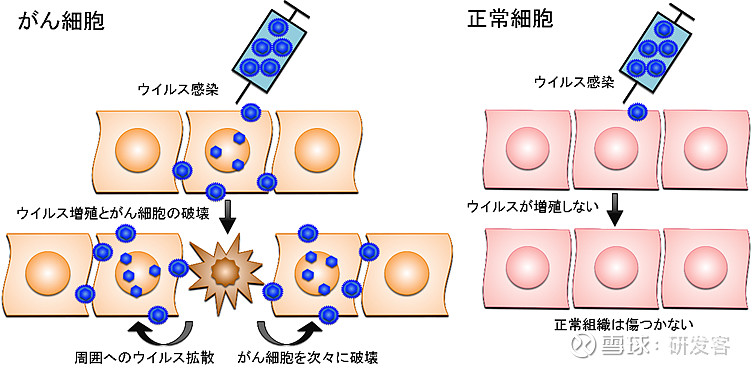
图1
20世纪90年代以后,在欧美开始使用转基因病毒的溶瘤病毒疗法,近年来溶瘤病毒药物的临床开发在世界上竞争加速。其中,应用HSV-1的开发领先。2015年10月,第二代溶瘤病毒药物T-vec(talimogene laherparepvec)被FDA批准,是首个在全球批准的溶瘤病毒药物,用于黑色素瘤患者的局部治疗。随后在欧洲和加拿大也得到了认可。研发溶瘤病毒的公司集中于欧美国家小型或新兴生物技术公司。全球目前正在进行的关于溶瘤病毒的临床试验超过100个。国内约有 10 家企业涉足溶瘤病毒开发,包括深圳亦诺微、中生复诺健、武汉滨会生物、天士力创世杰、养生堂、奥源和力等多个药企正在进行溶瘤病毒的开发,并取得了较大的进展。
什么是G47Δ?
据藤堂具纪教授介绍,HSV-1的3个病毒基因被改变(图2),在治疗癌症方面有许多优点。包括:1)能感染人的所有种类细胞;2)杀伤细胞能力较强;3)因抗病毒药物的存在,可中断治疗;4)即使患者拥有针对病毒的抗体,治疗效果也不会减弱。
为了引起抗肿瘤免疫,不仅对注射G47Δ的部位,对其他部位的癌症,也可得到期待的效果。G47Δ还能有效地破坏被认为阻碍癌症根治的肿瘤干细胞。
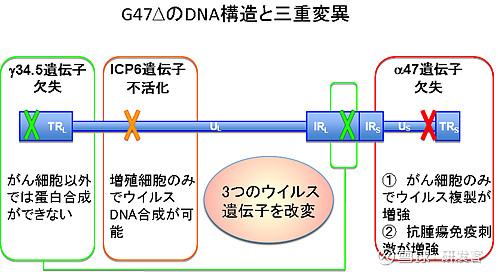
G47Δ的DNA结构和三种变异图2
据了解,胶质瘤约占原发性脑肿瘤的1/4,是典型的恶性脑肿瘤。由于进展迅速,临床尚无有效治疗手段,因此临床界期待着开发出像G47Δ这样的全新机制的治疗方法。
除了针对胶质母细胞瘤的试验以外,G47∆在所有评估的实体瘤模型中均显示有效,如神经胶质瘤、乳腺癌、前列腺癌、神经鞘瘤、鼻咽癌、肝细胞癌、结肠直肠癌、恶性周围神经鞘瘤和甲状腺癌等。
“医师主导的治验”
据日本行业人士介绍,在欧美,通常只用一个词语表示临床试验(clinical trial),而在日本,则分为“临床研究”和“临床试验”,并遵循不同的法令和审查途径。为获得上市生产和销售许可,必须进行以PMDA为申报窗口的注册临床试验。而“临床研究”则完全不同。与制药企业等一样,日本医生可自行开展研究,从方案设计到研究的实施、监测、监查和试验报告的提交等,所有业务都由医师自己实施和统筹,需要大量的资金和劳力。
据春天医药日本办事处负责人文英淑女士介绍,日本开展的IIT很多,相应的监管也十分严格。日本的《医药品医疗机器等法》是对以上市注册为目的临床试验进行监管,日本早年发生的几起临床试验利益冲突事件促成了MHLW颁发针对IIT监管的法案——《临床研究法》。为了恢复日本的临床研究的信赖度,2014年12月,MHLW开始讨论制定临床研究相关的制度。2018年4月,MHLW颁布了《临床研究法》,该法针对特定临床研究,包括针对未获批药品和超适应症及由制药企业提供资金开展的针对该制药企业的药品开展的临床研究。
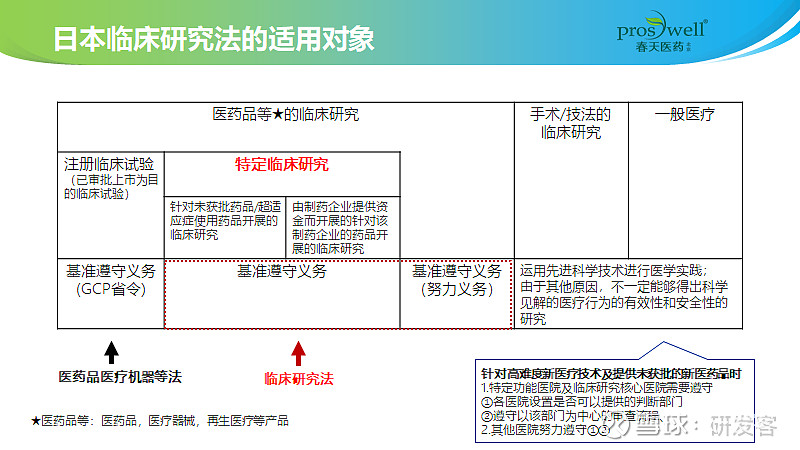
《临床研究法》实施措施包括:开展特定临床研究时,需要监查,遵守利益冲突管理等实施基准,取得受试者知情同意书,保护个人信息;针对开展特定临床研究的研究者,由MHLW大臣认定的临床研究审查委员会审查临床研究计划能否实施,待通过后,才可以向MHLW提交临床研究计划,并在指定的临床研究网站备案(jRCT:Japan Registry of Clinical Trials)。
可喜的是,为规范临床研究管理,提高临床研究质量,促进临床研究健康发展,中国国家卫健委在去年底发布了《IIT(研究者发起的临床研究)管理办法意见稿》。我国也终于有了针对医疗卫生机构开展的由研究者发起的临床研究的管理办法,该管理办法翔实具体,分八个章节。中山大学肿瘤防治中心临床研究部/国家药物临床试验机构的洪明晃教授说,这将令临床研究有法可依,敦促研究者对临床研究的科学性、伦理合规性负责,有助于推进药物研究的深度和广度,为循证医学及新药研发提供可靠依据。
后记
神户医疗产业都市推进机构医疗创新推进中心的福岛雅典教授曾在在《ARO自立化展望——确立研发循环生态》一文中提出,既然学术机构能自行出研究成果,医学和学术机构是否应该公司化,而不需要制药企业参与?研究者或发明人是否自行将实验室发现成果或临床研究结果推到上市阶段,并拥有销售权?文章提出,许多日本研究机构在转化成果给企业的过程中,没有得到应有的回报,现在学术机构是时候在新药开发过程介入更多、发挥更大的作用了。
笔者认为,药物研发是非常复杂和高度监管的系统工程,学术界和企业分工和角色定位不同,各有专长。学术机构专注学术,而企业有高效的资本和运作团队,加上在临床试验和注册申报上拥有丰富的经验及上市后销售网络,学术机构与企业合作,借力将新药研发延伸到后期直到上市,这种模式的优点显而易见。像第一三共制药和东京大学医科学研究所附属医院携手合作,才能将创新药从实验室成功推向临床,最终让患者获益。
参考文献:
国立大学法人东京大学
国立研究开发公司日本医学研究与开发组织 官网
本文特别感谢泰格医药高级顾问陈文、文英淑女士、倪东曜博士和浙江大学医学院和医学中心的盛弘强教授的帮忙。
